Advanced Materials|新型纳米平台为改进缺血性脑卒中药物治疗方案提供新思路!
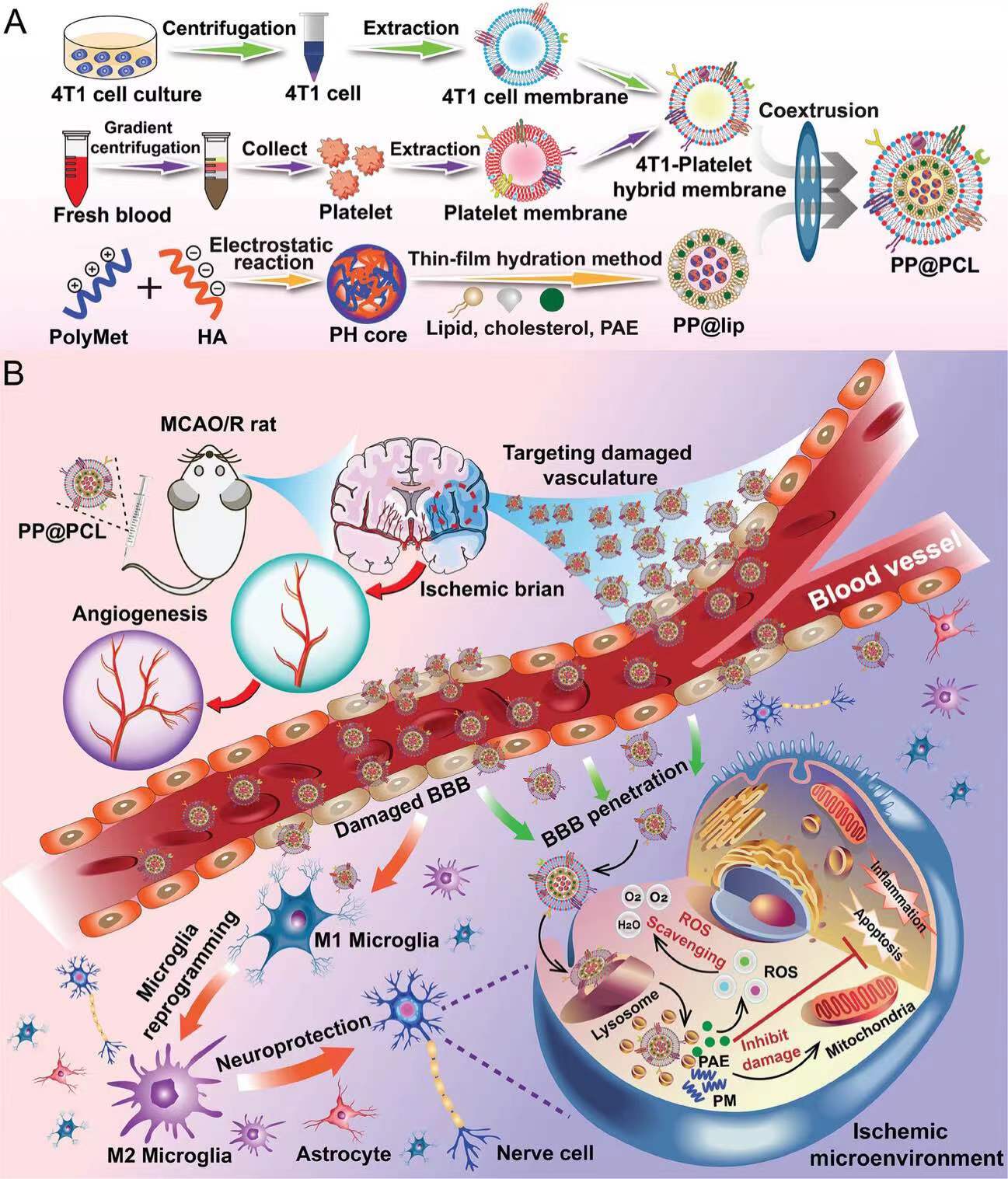
INTRODUCTION•✦研究介绍✦•研究背景Background缺血性脑卒中病理生理机制复杂,目前的缺血性脑卒中的治疗方案主要包括机械取栓与药物溶栓,以恢复血液再灌,恢复组织能量供应。但这些治疗方案的时间窗窄,并且伴随出血风险与缺血/再灌注损伤反应,因此改进缺血性脑卒中治疗方案,降低脑缺血/再灌注损伤,探索新的治疗途径是该领域的研究热点。目前的研究发现了许多改善缺血性中风溶栓再灌损伤的药物,但是因为血脑屏障的阻碍,限制了这些药物的治疗效果。研究目的Objectives如何突破血脑屏障的阻碍,最大程度发挥药物疗效?医用纳米材料领域相关学者在这个问题上做出了新的探索与突破。2024年2月,《Advanced Materials》上发表了一篇针对缺血性脑卒中病理生理机制构建的纳米药物递送平台的论著:METHODS•✦研究方法✦•研究重点Research Priorities在脑缺血再灌注损伤发生过程中,神经炎症是导致神经细胞死亡的重要机制之一,小胶质细胞是大脑主要的免疫细胞,在缺血性病变中,小胶质细胞会被激活并参与免疫反应,导致缺血性脑卒中的炎症反应。而小胶质细胞分为M1与M2型,经典途径激活的M1型小胶质细胞表现为促炎作用,交替激活的M2型小胶质细胞表现为抗炎作用,如何促小胶质细胞由M1型转变为M2型小胶质细胞,将促炎作用转变为抗炎作用,减轻神经炎症是本文研究重点之一。药物选择Drug Selection本文中运用到的主角药物之一“丹皮酚(PEA)”,是从中草药牡丹皮中分离得到的活性酚类植物化学物质,具有清除自由基、抗氧化、抗血小板聚集等药理活性,可重编促炎的M1小胶质细胞去极化为抗炎的M2小胶质细胞,可减轻小胶质细胞介导的神经炎症,具有良好的神经保护作用。除此之外,团队先前的工作发现,聚二甲双胍(Polymet)在激活AMPK介导的信号通路上具有良好的反应,AMPK通路的激活,具有重编程小胶质细胞向M2表型极化,抑制神经炎症的作用。药物递送平台Drug Delivery Platform Design为了探索这两种治疗药物的潜力,团队设计了一种新型靶向缺血性脑卒中病理生理特征并能透过血脑屏障的药物递送平台。优秀的纳米药物递送平台要具备良好的生物相容性,长效的血液循环能力及靶向病灶的能力,团队选取了可透过血脑屏障的4T1乳腺癌细胞膜与血小板膜来搭建该递送平台,该混合纳米囊泡将载有丹皮酚与Polymet的脂质体包裹在内,最终制备成了可穿透血脑屏障与靶向缺血性病灶能力的纳米载药颗粒(PP@PCL)。通过一系列的体内体外实验研究,发现该纳米药物递送平台具有良好的抗缺血性脑卒中功效,不仅可以通过清除ROS、缓解线粒体功能障碍和抑制神经炎症来保护神经元,还能极化小胶质细胞表型,促进血管生成和减少促炎细胞因子来重塑缺血微环境,延长大鼠生存期。FINDINGS•✦研究发现✦•结局1体外血脑屏障渗透性与靶向能力通过transwell建立的血脑屏障模型,以Coumarin6标记各组纳米平台,运用共聚焦显微镜与流式细胞术观察OGD/R(糖氧剥夺模型,缺血性脑卒中体外模型)处理的PC12细胞对纳米平台的摄取行为。巨噬细胞逃逸与纳米颗粒结合血管内皮细胞试验结果显示纳米平台具有良好的免疫逃逸能力与血管内皮靶向功能。结局2体外治疗效果及机制通过OGD/R模型建立缺血性脑卒中体外模型,通过活死细胞染色、细胞活力、LDH释放试验、Annexin V-FITC/PI实验、TUNEL、ROS含量检测发现PP@PCL NPs处理组细胞活力明显回升,LDH释放率、ROS含量降低、细胞凋亡率降低,补充材料中,划痕实验证明PP@PCL处理组细胞迁移能力增加,以上各试验结果证实了PP@PCL对体外模型的神经保护作用(图4)。除此之外,团队发现,PP@PCL NPs处理后的BV2细胞显著重塑了表型,表现为M2样小胶质细胞标志物CD206的表达增加,而M1标志物CD16/32的表达降低,并且促炎细胞因子TNF-α、IL-1β和IL-6显著降低,表明PP@PCL NPs发挥了良好的抗炎作用。结局3体内治疗效果与机制近红外荧光成像的结果显示,团队建立的仿生纳米平台在小鼠体内具有较强的血脑屏障渗透性和靶向能力,基于此,研究者随后对体内治疗效果进行评估。从激光散斑血流图像与TTC染色结果都可以看出,PP@PCL NPs治疗组脑部血流恢复增多且梗死体积明显减小,TUNEL阳性细胞减少,ROS阳性细胞减少,NeuN阳性细胞多于模型组,表明PP@PCL NPs治疗组细胞凋亡被抑制,神经元存活更多,该纳米平台具有良好的神经保护作用。由于二甲双胍在MCAO/R后诱导缺血性脑血管生成,研究者想探究Polymet是否可以继承二甲双胍的这一特征。因此,他们通过对新生脑微血管内皮细胞的典型标志物CD31进行免疫荧光染色,探索了不同NPs的血管生成作用。与生理盐水处理组相比,PolyMet参与组的CD31荧光强度显著增强,表明PolyMet对增强脑血管密度的有效性,基于此,可以合理地推断,PP@PCL NPs由于其改善脑微循环的能力而能够恢复神经功能。在体外实验中得出的PP@PCL NPs能够重塑炎症细胞表型以抗炎的结论在体内实验中也得到了验证。不同处理后的缺血性脑切片分别与Iba-1和CD16/32共染色以标记M1型小胶质细胞,Iba-1和CD206分别标记M2型小胶质细胞。免疫荧光结果显示,与假手术组相比,Iba-1在MCAO/R后大鼠缺血性脑组织中高表达,表明缺血性病变处小胶质细胞浸润。接受PP@lip和PP@PCL治疗的大鼠脑切片中M1样小胶质细胞的数量显着减少。用PAE@lip、PP@lip和PP@PCL处理后缺血半影中M2样小胶质细胞的数量是生理盐水处理组的4.8倍、6.9倍和8.8倍。由此可见,研究者设计的治疗策略可有效诱导脑缺血微环境中小胶质细胞表型的重编程,发挥抗炎作用。DISCUSSION•✦研究讨论✦•效果显著提供药物治疗新思路这项研究针对缺血性脑卒中的病理生理机制与病灶微环境,设计了一种具有渗透血脑屏障与病灶靶向能力的纳米平台,通过加载治疗药物丹皮酚与Polymet,实现了协同抗缺血性脑卒中损伤的作用。该材料不仅具有优秀的缺血性病灶靶向能力,还具有良好的治疗效果,可有效清除过量ROS,促进神经血管生成,还可重塑小胶质细胞表型,使其极化为M2型小胶质细胞,减少促炎细胞因子的分泌,重塑了缺血性微环境,发挥了良好的神经保护作用。研究者通过WB、MDA、SOD与促炎细胞因子水平等实验方法对脑组织样本检测,综合结果显示该纳米平台的治疗机制涉及调节Bcl2/Bax/caspase-3蛋白表达,具有良好的抗凋亡作用,结合水迷宫实验对MCAO/R大鼠进行学习能力和空间记忆考核,发现该纳米平台治疗处理的MCAO/R大鼠神经功能与记忆功能显著改善。这是首次将PAE与Polymet共装载入纳米平台用于缺血性脑卒中治疗的研究,这项研究可能会为改进缺血性脑卒中药物治疗方案提供新的思路。参考文献[1] L. Tang, Y. Yin, H. Liu, M. Zhu, Y. Cao, J. Feng, C. Fu, Z. Li, W. Shu, J. Gao, X.-J. Liang, W. Wang, Blood–Brain Barrier-Penetrating and Lesion-Targeting Nanoplatforms Inspired by the Pathophysiological Features for Synergistic Ischemic Stroke Therapy. Adv. Mater. 2024, 2312897. https://doi.org/10.1002/adma.202312897PROFILE王伟博士,教授,博士生导师,岛津青年学者,中国药科大学最受欢迎教师,中国药学会-中恒青年药剂学奖获得者,江苏省“六大人才高峰”高层次人才,江苏省科协首席专家,美国北卡罗来纳大学教堂山分校(UNC)访问学者(导师:Prof. Leaf Huang)研究领域:新型药用微/纳米材料的设计,及其靶向药物递送与联合治疗系统的研究重点聚焦4个子方向:(1)基于高分子聚合物/脂质体的靶向药物传递系统研究(2)基于高密度脂蛋白的多药同靶点联合传输系统研究(3)基于多功能无机材料的疾病诊疗一体化纳米颗粒研究(4)基于仿生/细胞载体的药物/基因精准递送体系研究PROFILE梁兴杰梁兴杰,博士后,博士生导师,享受政府特殊津贴。现任中国科学院重点实验室“纳米生物效应与安全性实验室”副主任,中科院纳米科学卓越中心纳米药物组负责人,中国生物物理学会纳米生物学分会主任等。研究领域:探索和发现新型纳米药物在纳米尺度上独特的分子和细胞学特性,以及纳米技术改进化疗药物疗效和生物利用度的研究。重点聚焦子方向:纳米药物的设计合成、结构优化和功能测定及其应用中克服临床适应性耐受的生物机制。END文案 | 刘惠棋排版 | 夏小倩审核 | 夏小倩发布|姜笑南世界生命科学大会RECRUIT关注我们,获取生命科学学界前沿|促进更多的学术交流与合作业界前沿|促进更快的产品创新与应用政策前沿|促进更好的治理实践与发展
 2024-05-16
2024-05-16

 2024-05-16
2024-05-16
 2024-05-16
2024-05-16

 2024-05-16
2024-05-16

 2024-05-16
2024-05-16

 2024-05-16
2024-05-16